【安全性評価】次亜塩素酸ナトリウムは注意して使って【人体への霧状噴霧・吸入は避けて】

殺菌、漂白目的で使用される次亜塩素酸ナトリウムは、家庭用のものは3%~8%程度の濃度で使用されることが多いです。継続的な手指皮膚への使用、目への混入、肺からの吸入など誤用すると健康被害を起こすことが分かっていますので、使用には専門家の知識と注意が必要です。家庭で使用する場合は人体にはかからないようにしましょう。
次亜塩素酸ナトリウムとは
次亜塩素酸ナトリウム|Sodium hypochlorite(NaClO)は、モル質量74.44 g/mol、密度1.11 g/cm³、沸点101度、CAS7681-52-9、強塩基pH>11で、殺菌、消毒、漂白剤に使用され、希釈水溶液はアンチホルミンとも呼ばれ、次亜塩素酸ソーダとも呼ばれます。次亜塩素酸ナトリウムの個体は白色、水溶液では薄い黄色を呈するとされています。
2NaOH + Cl2 → NaCl + NaClO + H2O
高濃度の次亜塩素酸ナトリウムは反応性が高いためすぐに分解するが、適度な濃度で水溶液になっているとしばらくは安定、消毒液としても役に立つレベルを維持できます。しかし、直射日光の当たり具合などで分解が進んでしまうため、冷暗所にて保存、使用します。
次亜塩素酸ナトリウムと次亜塩素酸水の違い
【次亜塩素酸ナトリウム】
キッチンハイターやハイターなどに含まれているものです。次亜塩素酸ナトリウム(NaClO)を水に希釈したもの。この次亜塩素酸ナトリウム(NaClO)を水に溶かしても次亜塩素酸水は生成できません。ドアノブや手指接触部位の消毒のために、適度に希釈されて使われるのはこちらの次亜塩素酸ナトリウムを希釈したものです。
【次亜塩素酸水】
塩酸(HCl)や塩化ナトリウム(NaCl)を電気分解して生じるものです。次亜塩素酸ナトリウムを希釈しても、有効成分として似たようなものが多少できますが、製法と用途が若干異なります。後述の通り、次亜塩素酸ナトリウム水溶液のpHを酸性よりにすると、次亜塩素酸水に近いものができますが、あくまで近いものです。
※注意
2020年5月時点では、これらの消毒薬が何に効いて、何に効かないかは断言できません。ネットニュースや新聞で効くかどうかの記述があった時は、その証拠となる情報源URLへのリンクが有るかどうか、また、その情報源中に実験手法と実際の結果が正しく書かれているか確認しましょう。SNS上で医師を名乗るアカウントであっても、信用に足るとは限りません。必ず情報源として何を見て言っているのか、科学的かつ紳士的な研究と議論の上で、各自判断しましょう。
厚生労働省発行のPDFより、次亜塩素酸ナトリウムと次亜塩素酸水の違いについて触れておきます。似たようなものですが、若干違います。一般の方にはわかりにくいものだと思いますので、引用元PDFをしっかりチェックして違いを理解するよう努めていただきたいです。
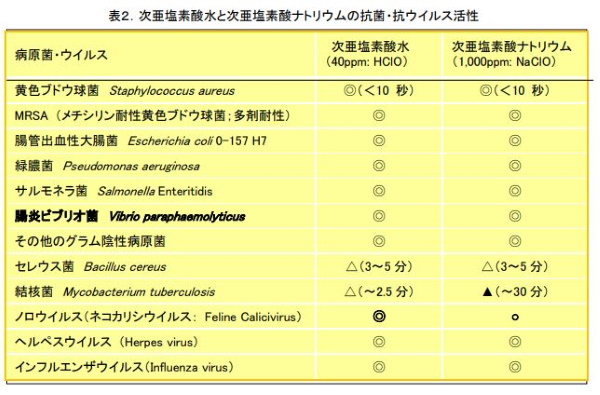
こちらの画像は引用元PDFからのものです。濃度や病原菌・ウイルスによって効き方に差があり、必ずしも効果があるとはそもそも言えませんが、大体のものにはある程度作用してくれると考えて良いでしょう。
次亜塩素酸水 | 次亜塩素酸ナトリウム | |
| 主成分 | 次亜塩素酸(HClO)>塩素(Cl2) >>ClO - | 次亜塩素酸イオン(ClO-)>HClO |
| 酸性 | 酸性pH2~6ほど | アルカリ性pH11~12ほど |
安全性 1.手荒れ 2.環境負荷 3.トリハロメタン生成 | 1.ほとんどなし 2.ほとんどなし 3.生成なし | 1.あり 2.あり 3.あり |
| 有効塩素濃度 | 希釈せず早期に使用 20~60ppm(強酸性) 10~30ppm(微酸性) | 希釈して使用 100~10,000ppm |
出典:次亜塩素酸水と次亜塩素酸ナトリウムの同類性に関する資料
https://www.mhlw.go.jp/shingi/2009/08/dl/s0819-8k.pdf
有効成分は次亜塩素酸|HClO
水溶液中などで、次亜塩素酸(HClO)や次亜塩素酸イオン(HClO–)となり、主な有効成分として働きますが、希塩酸など添加してpH=6程度にしておくと最も殺菌力を発揮する次亜塩素酸(HClO)の割合が高くなります。このため、市販の次亜塩素酸ナトリウム水溶液に基づく殺菌・消毒・漂白剤は皮膚にとってはあまり良いものではなく、殺菌どころか肌荒れも起こしてしまうものです。
次亜塩素酸ナトリウムの作用機序について

(CC)画像出典:SciELO
ブラジルの歯科ジャーナル出版より、歯科治療、根管洗浄液としての使用の場合、次亜塩素酸ナトリウム水溶液の濃度が0.5%~1%程度の場合は、生物学的に許容範囲にある(一応安全と言えるレベル:例外あり)とされています。これは微量の経口摂取の許容量とも言えるかもしれませんが、それほどに濃度を低くしないと人体には有害で、継続摂取があればさらに危険性が増します。
細胞代謝とリン脂質の破壊、細胞代謝を妨害するクロラミンの形成、細菌の不可逆的な酵素的不活性化による酸化作用があるとされています。次亜塩素酸ナトリウムは、脂質と脂肪酸を分解することで、細菌やウイルスを死滅させていると考えて良いでしょう。
次亜塩素酸ナトリウム(NaClO)が、脂肪酸を脂肪酸塩(石鹸)およびグリセロール(アルコール)に変換し、残りの溶液の表面張力を低下させる。
アミノ酸を中和して水と塩を形成、ヒドロキシイオンが出ると、pHが低下。
次亜塩素酸(HClO)は、有機組織と接触すると溶媒として作用し、タンパク質のアミノ基と結合してクロラミンを生成する塩素を放出。
アミノ酸分解および加水分解を起こす。
塩素とアミノ基(NHー)の塩素化反応で、細胞代謝を妨害するクロラミンを形成。
塩素は、細菌の酵素の働きを阻害する抗菌作用を示し、必須の酵素のSHグループ(スルフヒドリル基)の不可逆的な酸化を引き起こす。
安全性評価と危険性
混ぜるな危険
酸性の強い塩酸(トイレ用・風呂用洗剤、水垢取り、クエン酸、炭酸)と次亜塩素酸ナトリウムを混ぜると塩素を生じます。
NaClO + 2HCl → NaCl + H2O + Cl2
ここで発生する塩素ガスは、実際に事故で死に至る事例がある危険なものです。誤って子どもが色んな殺菌を合わせればよいだろうと混ぜて使用すると最悪死亡事故が起きます。無知なYouTuberなどが実験として遊び半分でやってしまうと犯罪にも死亡事故にもなるため、遊び半分、ネタ半分でやって良いようなものではありません。
工業利用時の注意|暴露限界
Industrial use of bleach is very commonplace, particularly with buildings that have a large, public exposure, such as pools, hospitals, restaurants, etc. There are industrial-strength bleaches available for this type of cleaning, with the sodium hypochlorite compound comprising approximately 10-12 percent of the overall industrial bleach mixture. Therefore, industrial exposure and use has higher risks than normal household use.
The NIOSH recommended exposure limit (REL) is 0.5 part per million (ppm), which should not be exceeded during any 15 minute work period. The American Industrial Hygiene Association recommends a Workplace Environmental Exposure Level (WEEL) of 2 mg/m (milligrams of a chemical in a cubic meter of air) for a 15 minute work period.
引用元:MSDSOnline
【翻訳】
漂白剤の工業的使用は非常に一般的です。特に、プール、病院、レストランなどの公共の露出が大きい建物では、このタイプの洗浄に使用できる工業用漂白剤があり、次亜塩素酸ナトリウム化合物は産業用漂白剤全体の10~12%です。したがって、工業的な曝露と使用は、通常の家庭での使用よりもリスクが高くなります。
NIOSHの推奨暴露限界(REL)は0.5 ppm(100万分の1)であり、15分の作業期間中にこれを超えてはなりません。アメリカ産業衛生協会は、15分の作業時間で「2mg / m2」(ミリグラムの化学物質)の職場環境暴露レベル(WEEL)を推奨しています。
消毒作業を行う場合、作業時間15分の間に1m四方の空間内で2mg相当値までしか暴露されてはいけないとされています。工業用の場合は次亜塩素酸ナトリウムの濃度も濃くなる可能性が高いため、きちんと防護体制をとった上で、化学マスクの耐久も考慮した上で、肌にも目にも入らないような状態でしなければいけません。
ラットの半数致死量LD50について
Hypochlorous acid generates superoxide radicals that cause oxidative injury and cell death. Single-dose toxicity studies in rats using 1.1% NaOCl solutions were also done to establish the LD50 of the chemical (LD50 is the dose required to be lethal in 50% of tested animals). The LD50 was calculated to be 290 mg/kg of an oral dose and 33.3 mg/kg of an intravenous dose.
次亜塩素酸はスーパーオキシドラジカルを生成し、酸化的損傷や細胞死を引き起こします。1.1%NaOCl溶液を使用したラットの単回投与毒性研究では、LD 50は、経口投与で290 mg / kg、静脈内投与で33.3 mg / kgと計算されました。
(LD 50は、試験動物の50%致死的用量、半数致死量)
マウスの実験をそのまま人に当てはめて計算するのはあまり意味はないかもしれませんが、この数値を体重60kgの人に当てはめると
1.1%NaOCl溶液の単回投与
経口投与
17400mg(=17.4g)/60kg
静脈内投与
1998mg(=1.998g)/60kg
となり、静脈内投与では1.1%NaOCl溶液を2gも投与すると体重60kgの人の半数が死に至る量だということになります。多いと感じるか、少ないと感じるかは個人の感覚ですが。
皮膚への影響
When NaOCl is applied topically, there is no published evidence of systemic toxicity and local reactions have not been reported to be life-threatening [1]. Dermal toxicity studies performed in rodents and rabbits by exposing shaved skin to 1.1% NaOCl solution, showed no signs of significant local irritation after 14 days of testing. Guinea pigs examined for inflammatory response to subcutaneous exposure to NaOCl at low concentrations showed no significant difference in local inflammatory response in any of the sites when compared to those treated with normal saline [3]. However, single-dose studies performed on animals using higher concentrations have found toxic reactions to intradermal injections. In a study by Pashley et al. [2], intradermal injection of 5.25% NaOCl produced immediate hemorrhage and edema lasting hours after injection. These findings demonstrate the varying toxicity of NaOCl depending on the route of administration and concentration. It is important to note that in many of these studies, low concentrations were studied because of how it is used in medicine. In commercial and industrial situations, bleach is found in much higher concentrations and is likely to produce more damage.
【翻訳】
NaOClが局所的に使用された場合、全身毒性の証拠はなく、局所反応が生命を脅かすものであると報告されていません[ 1 ]。げっ歯類とウサギで剃毛した皮膚を1.1%NaOCl溶液に曝露して行った皮膚毒性試験では、14日間の試験後に局所刺激の兆候は見られませんでした。低濃度のNaOClへの皮下曝露に対する炎症反応を調べたモルモットは、通常の生理食塩水で治療したものと比較した場合、どの部位でも局所炎症反応に有意差はありませんでした[ 3 ]。ただし、高濃度を使用して動物で実施された単回投与の研究では、皮内注射に対する毒性反応が見つかりました。パシュリーらによる研究で。[ 2]、5.25%のNaOClの皮内注射は、注射後数時間持続する即時の出血および浮腫を引き起こした。これらの調査結果は、投与経路と濃度に応じてNaOClの毒性が変化することを示しています。これらの研究の多くでは、医療での使用方法が原因で低濃度が研究されたことに注意することが重要です。商業的および産業的状況では、漂白剤ははるかに高い濃度で見られ、より多くの損傷を引き起こす可能性があります。
上記翻訳・引用内にあるように、濃度の大きい次亜塩素酸ナトリウムを皮膚に暴露すると肌荒れだけでなく、出血や浮腫を起こす可能性がある事がわかっています。この実験の場合はげっ歯類のものですが、人でも同様にリスクがあることはすでに分かっています。
ここまでの知見より、0.5%~1.1%NaOCl溶液程度の濃度で、単回の暴露あれば人体にそれほど有害ではない、または、目立った害は即座には見受けられないと考えて良いでしょう。
胃腸への影響
In one such case, a 66-year-old female ingested a large quantity of household bleach (sodium hypochlorite 5.25%) and presented with severe esophageal and airway burns along with perforation of the gastroesophageal junction, bilateral pneumothorax and pneumoperitoneum. The case was complicated by severe metabolic acidosis and cardiopulmonary arrest, which resulted in the woman’s death [11].
【翻訳】
66歳の女性のケースでは、大量の家庭用漂白剤(5.25%次亜塩素酸ナトリウム)を摂取し、胃食道接合部、両側気胸および気腹の穿孔とともに重度の食道および気道の火傷を呈した。この症例は、重度の代謝性アシドーシスと心肺停止により複雑化し、その結果女性は死亡した[ 11 ]。
次亜塩素酸ナトリウムの作用機序については先に説明した通り、強い酸性のものと混合することで、次亜塩素酸ナトリウムは塩素を発生します。この塩素や反応そのものが食道や気道に火傷を起こして、結果的に死亡したとされています。
説明するまでもなく、家庭用の5.25%の次亜塩素酸ナトリウムでも、大量に飲めば死に至り、少量でも飲めば害を残すと考えて良いでしょう。
肺への影響
Patients who ingest bleach often have damage to the respiratory tract as well as the esophagus. The damage may be due to inhaled vapors of bleach or could be related to aspiration during ingestion or vomiting afterward. If severe, a patient with respiratory tract damage may require intubation and mechanical ventilation for respiratory distress or acute respiratory distress syndrome (ARDS). Mechanical ventilation with ARDS can lead to AKI by different mechanisms including hypoxemia, hypercapnia, barotrauma-induced inflammatory response and hemodynamic changes well described by Kuiper et al. [12].
重症の場合、呼吸器障害のある患者は、呼吸困難または急性呼吸窮迫症候群(ARDS)のため、挿管と人工呼吸を必要とする場合があります。ARDSによる機械的換気は、低酸素血症、高炭酸ガス血症、気圧外傷によって誘発された炎症反応、Kuiper らによって詳細に説明されている血行力学的変化など、さまざまなメカニズムによってAKIを引き起こす可能性があります。
次亜塩素酸ナトリウムは、胃腸への影響同様、気道に影響を与えて損傷させてしまいます。損傷により正常に呼吸できなくなり、呼吸困難を招き死に至る可能性がある上に、肺から血管に次亜塩素酸ナトリウムが吸収されていってしまった場合は、溶血を起こすため、これもまた死に至る原因となるでしょう。
【血液毒性】
NaOCl breaks down into water and hypochlorous acid immediately when it is mixed with plasma. Hypochlorous acid then induces hemolysis almost immediately through membrane protein modification. Experiments have shown that hypochlorite produces visible hemolysis at various concentrations in <1 min.
次亜塩素酸ナトリウム(NaOCl)は、血漿と混合されるとすぐに水と次亜塩素酸(HClO)に分解されます。次に、次亜塩素酸は、膜タンパク質の修飾を通じてほぼ即座に溶血を誘発します。実験により、次亜塩素酸塩は1分未満でさまざまな濃度で目に見える溶血を生じることが示されています。
腎毒性もあり
【重要】霧状の次亜塩素酸ナトリウムは危険か
危険です
生活圏内において、次亜塩素酸ナトリウム水溶液を散布する場合、その消毒散布薬内の次亜塩素酸ナトリウムの濃度と、周囲に人がいる状況での散布なのかどうかが影響します。これまでのデータや引用元より
- 5.25%以上の次亜塩素酸ナトリウムは有害
- 0.5%~1%の次亜塩素酸ナトリウムは危険性は低いが無害ではない
と言えるでしょう。市販の次亜塩素酸ナトリウム水溶液は、薄すぎれば意味はほとんどなく気休めにもならないですが、濃度が濃いものに関しては工業用途となり、濃度を十分に薄められていない事例もあります。
本人は0.02%~0.1%程度に希釈した次亜塩素酸ナトリウムを使用していたつもりが、計算を間違えた、または、希釈が適当だった、継ぎ足して使ったために、濃度が0.2~1.0%の次亜塩素酸ナトリウム水溶液として噴霧していた、ということもあります。消毒、殺菌、漂白はできるかもしれませんが、濃度の大きすぎるものを人体が触れる部位に散布すれば肌荒れや気道損傷を招きます。
「ハイター」と「キッチンハイター」は、次亜塩素酸ナトリウム濃度が6%になるように生産されています。
(直射日光にあたる場所や高温での保管をしていない場合)
0.02% (200ppm)以上* | 0.05% (500ppm)以上* | 0.1% (1000ppm)以上* | |
生産時の濃度6%の場合 | 水3リットルに | 水3リットルに | 水3リットルに |
購入から3ヶ月以内 | 水3リットルに | 水1リットルに | 水1リットルに |
購入から1年以内 | 水3リットルに | 水1リットルに | 水1リットルに |
購入から3年以内 | 水3リットルに | 水1リットルに | 水1リットルに |
ハイターを薄めて使用する場合には、花王の上記ページなどを参考にして、正しく薄めて、正しく使用しましょう。当然、肌が弱い方がいる場合には規定の濃度でも肌荒れを起こす可能性があり、赤ちゃんや高齢者がいる場所ならば、結果的に吸入となるような状況も絶対に避けなければいけません。
食品衛生法に基づく使用基準
かんきつ類果皮(菓子製造に用いるものに限る)、さくらんぼ、生食用野菜類、卵類(卵殻の部分に限る。以下この目において同じ。)、ふき、ぶどう及びもも以外の食品に使用してはならない。亜塩素酸ナトリウムの使用量は、亜塩素酸ナトリウムとして生食用野菜類及び卵類にあっては浸漬液1kg につき 0.50g 以下でなければならない。また、使用した亜塩素酸ナトリウムは、最終食品の完成前に分解し、又は除去しなければならない。
食品安全基本法(平成 15 年法律第 48 号)第 24 条第 1 項第 1 号の規定に基づき、平成 15 年10 月 20 日付厚生労働省発食安第 1020004 号により食品安全委員会あて意見を求めた亜塩素酸ナトリウムに係る食品健康影響評価について、以下のとおり評価案が提案されている。
一日摂取許容量
(ADI)0.029mg/kg体重/日
(亜塩素酸イオンとして)
過剰な見積もりになることを前提に「平成 13 年度統計局食糧需給」の果実、野菜の値をもとに推定し、カズノコ(調味加工品)については、国内生産量をもとに推定した(0.2g/日)
ところ、対象食品の1日摂取量は、398g/日と推定された。過剰な見積もりではあるが、日本人の平均体重を 50kg とし、対象食品に現公定法における検出限界(1mg/kg)程度の亜塩素酸ナトリウムが含まれていたと仮定した場合、1日に摂取される亜塩素酸ナトリウムの量は 7.96 g/kg 体重/日(亜塩素酸イオンとして 5.94 g/kg 体重/日)と推定される。
出典引用元:https://www.mhlw.go.jp/shingi/2005/03/dl/s0324-20d.pdf
少し古い文書ではありますが、厚生労働省発行のPDFでは1日の摂取許容量が記載されています。これは体重60kgの人の場合1日に「1.74mg」までが許容量だということになります。
全体での曝露量は減らしたい
2020年5月現在、シビアな時期で、どんな店舗でも次亜塩素酸ナトリウム水溶液を散布しつつ、消毒しつつ使用している可能性があります。あちこちの店舗で低濃度の次亜塩素酸ナトリウム水溶液が散布されていて、あちこちで吸ってしまっていたら、低濃度でも何かしら影響が出てしまう可能性はあります。
アルバイトやパートのスタッフが、20分や30分おきに次亜塩素酸ナトリウム水溶液を散布していれば、その軽装のスタッフ自身も危険ですし、潜在的に気道を損傷する可能性があります。
かといって消毒はやめられないものですので、敏感な方や不安な方は手袋をするなど工夫し、ウイルス対策・花粉症予防のためだけでなく、こうした散布される消毒液の吸入を少しでも減らすかもしれない「マスク」を着用し、適度に手を洗い、うがいをして安全を守りましょう。
出典
Bleach (Sodium Hypochlorite) Safety Tips: Bleach Safety Instruction
Mechanism of action of sodium hypochlorite
https://www.scielo.br/scielo.php?pid=S0103-64402002000200007&script=sci_arttext
Topical Antimicrobial Toxicity
https://jamanetwork.com/journals/jamasurgery/article-abstract/590883
Sodium hypochlorite dental accidents
https://www.tandfonline.com/doi/abs/10.1179/2046905512Y.0000000042
Spectrum of sodium hypochlorite toxicity in man—also a concern for nephrologists
https://academic.oup.com/ckj/article/4/4/231/344459
Toxicity and Safety of Topical Sodium Hypochlorite
https://www.karger.com/Article/Abstract/96812
安全な次亜塩素酸ソーダの取扱い|日本ソーダ工業会
https://www.jsia.gr.jp/data/handling_03.pdf
社団法人・日本水道協会|水道用次亜塩素酸ナトリウムの取扱い等の手引き(Q&A)
http://www.jwwa.or.jp/houkokusyo/pdf/200803_suidouyou_guideline.pdf
花王|次亜塩素酸ナトリウムとは?
https://pro.kao.com/jp/product-support/law/06/
次亜塩素酸水の食品添加物指定に関連する資料
https://www.mhlw.go.jp/shingi/2009/08/dl/s0819-8m.pdf
記載人
山梨大学工学部生命工学科卒業|生命工学士
当サイト管理人
※内容に不備やミスがあった場合にはお手数ですが、コメント欄やお問い合わせよりお知らせください。